Số phối trí của nguyên tử trong phân tử là số nguyên tử liên kết với nguyên tử. Trong hóa học và tinh thể học, số phối trí mô tả số nguyên tử lân cận đối với nguyên tử trung tâm. Thuật ngữ này ban đầu được định nghĩa vào năm 1893 bởi nhà hóa học Thụy Sĩ Alfred Werner (1866–1919). Giá trị của số phối trí được xác định khác nhau đối với các tinh thể và phân tử. Số phối trí có thể thay đổi từ thấp đến 2 đến cao là 16. Giá trị phụ thuộc vào kích thước tương đối của nguyên tử trung tâm và các phối tử và bởi điện tích từ cấu hình điện tử của ion.
Bạn đang xem: Số phối trí là gì
Số phối trí của một nguyên tử trong phân tử hoặc ion đa nguyên tử được tìm thấy bằng cách đếm số nguyên tử liên kết với nó (lưu ý: không phải bằng cách đếm số liên kết hóa học).
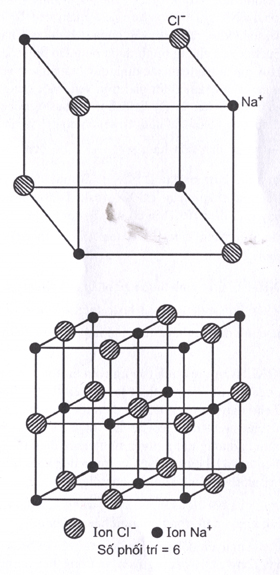
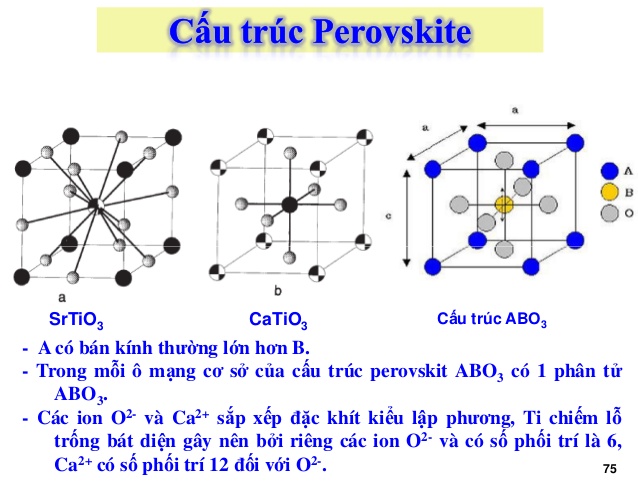
Khó khăn hơn để xác định liên kết hóa học trong tinh thể ở trạng thái rắn, vì vậy số phối trí trong tinh thể được tìm thấy bằng cách đếm số nguyên tử lân cận. Thông thường nhất, số phối trí nhìn vào một nguyên tử ở bên trong mạng tinh thể, với các hàng xóm mở rộng theo mọi hướng. Tuy nhiên, trong một số bối cảnh nhất định, bề mặt tinh thể rất quan trọng (ví dụ, xúc tác không đồng nhất và khoa học vật liệu), trong đó số phối trí cho một nguyên tử bên trong là số phối trí khối và giá trị cho một nguyên tử bề mặt là số phối trí bề mặt .
Xem thêm: Realtek High Definition Audio Driver Là Gì, Giải Thích Tải ở đâu An Toàn
Trong các phức chất phối trí , chỉ liên kết đầu tiên (sigma) giữa nguyên tử trung tâm và các phối tử được tính. Liên kết pi với các phối tử không được tính đến.
Xem thêm: D01 Là Môn Gì – Khối D01 Gồm Những Môn Nào
Ví dụ về số điều phối
Cacbon có số phối trí là 4 trong phân tử metan (CH 4 ) vì nó có bốn nguyên tử hydro liên kết với nó.Trong etylen (H 2 C = CH 2 ), số phối trí của mỗi cacbon là 3, trong đó mỗi C liên kết với 2H + 1C với tổng số 3 nguyên tử.Số phối trí của một viên kim cương là 4, vì mỗi nguyên tử cacbon nằm ở tâm của một tứ diện đều do bốn nguyên tử cacbon tạo thành.
Xác định vị trí của nguyên tử, phân tử hoặc ion gần nguyên tử kim loại trung tâm nhất. Để làm điều này, hãy tìm phân tử hoặc ion ngay bên cạnh ký hiệu kim loại trong công thức hóa học của hợp chất phối trí. Nếu nguyên tử trung tâm ở giữa công thức, sẽ có các nguyên tử / phân tử / ion lân cận ở cả hai phía.Cộng số nguyên tử của nguyên tử / phân tử / ion gần nhất. Nguyên tử trung tâm có thể chỉ được liên kết với một nguyên tố khác, nhưng bạn vẫn cần lưu ý số nguyên tử của nguyên tố đó trong công thức. Nếu nguyên tử trung tâm ở giữa công thức, bạn sẽ cần cộng các nguyên tử trong toàn bộ phân tử.Tìm tổng số nguyên tử gần nhất. Nếu kim loại có hai nguyên tử liên kết, hãy cộng cả hai số lại với nhau,
Số phối hợp 2 —linearSố phối trí 3 — hình phẳng tam giác (ví dụ, CO 3 2- ), hình chóp tam giác, hình chữ TSố phối trí 4 — hình tứ diện, hình vuôngSố phối trí 5 — kim tự tháp hình tròn (ví dụ: muối oxovanadium, vanadyl VO 2+ ), kim tự tháp ba giác, Số phối trí 6 — hình phẳng hình lục giác, hình lăng trụ tam giác, hình bát diệnSố phối trí 7 — hình bát diện có mặt phẳng, hình lăng trụ tam giác có giới hạn, hình chóp tứ giácSố phối trí 8 —decahedron, cube, antiprism vuông, bipyramid lục giácSố phối trí 9 — lăng kính tam giác có tâm ba mặtSố phối trí 10 — đối cực vuông khuyết tậtSố phối trí 11 — lăng kính tam giác có mặt đềuSố phối trí 12 — khối đa diện (ví dụ, amoni nitrat Ceric – (NH 4 ) 2 Ce (NO 3 ) 6 )
Deutsch Español 한국어 Italiano português tiếng việt ελληνικά dansk Nederlands Русский язык Українська हिन्दी Bahasa Melayu român polski ภาษาไทย slovenčina العربية 日本語 български српски Français magyar Suomi čeština Svenska Türkçe Bahasa Indonesia
Chuyên mục: Hỏi Đáp