Đối tượng
Tim mạchBệnh mạch máu
trừu tượng
Các nghiên cứu đã được thực hiện để kiểm tra bất kỳ vai trò nào đối với trục hepcidin / ferroportin trong các phản ứng tăng sinh của các tế bào cơ trơn động mạch phổi của con người (hPASMCs). Những phát hiện hoàn toàn mới lạ đã chứng minh sự hiện diện của ferroportin trong hPASMC. Điều trị Hepcidin gây ra sự tăng sinh của các tế bào này rất có thể bằng cách liên kết với ferroportin dẫn đến nội hóa và giữ sắt của tế bào. Hàm lượng sắt trong tế bào tăng lên khi điều trị hepcidin. Ổn định biểu hiện và hoạt động của ferroportin thông qua can thiệp với kháng thể đơn dòng trị liệu LY2928057 đảo ngược sự tăng sinh và tích lũy sắt của tế bào. Ngoài ra, điều trị IL-6 đã được tìm thấy để tăng cường sự tăng sinh và tích lũy sắt trong hPASMC; can thiệp với LY2928057 đã ngăn chặn phản ứng này. IL-6 cũng đã được tìm thấy để tăng phiên mã hepcidin và giải phóng từ hPASMC cho thấy phản ứng tự động tiềm tàng. Tích lũy sắt qua trung gian Hepcidin hoặc IL-6 góp phần tăng sinh trong hPASMC; ferroportin qua trung gian bài tiết sắt tế bào hạn chế sự tăng sinh. Huyết sắc tố cũng gây ra sự tăng sinh của hPASMC; trong các phát hiện mới khác, CD163, thụ thể hemoglobin / haptoglobin, đã được tìm thấy trên các tế bào này và cung cấp một phương tiện cho sự hấp thu sắt của tế bào thông qua hemoglobin. Il-6 cũng được tìm thấy để điều chỉnh CD163 trên các tế bào này. Những dữ liệu này góp phần hiểu rõ hơn về việc làm thế nào sự phá vỡ cân bằng nội môi sắt có thể gây ra sự tái tạo mạch máu, chẳng hạn như trong tăng huyết áp động mạch phổi.
Bạn đang xem: Hepcidin là gì
Giới thiệu
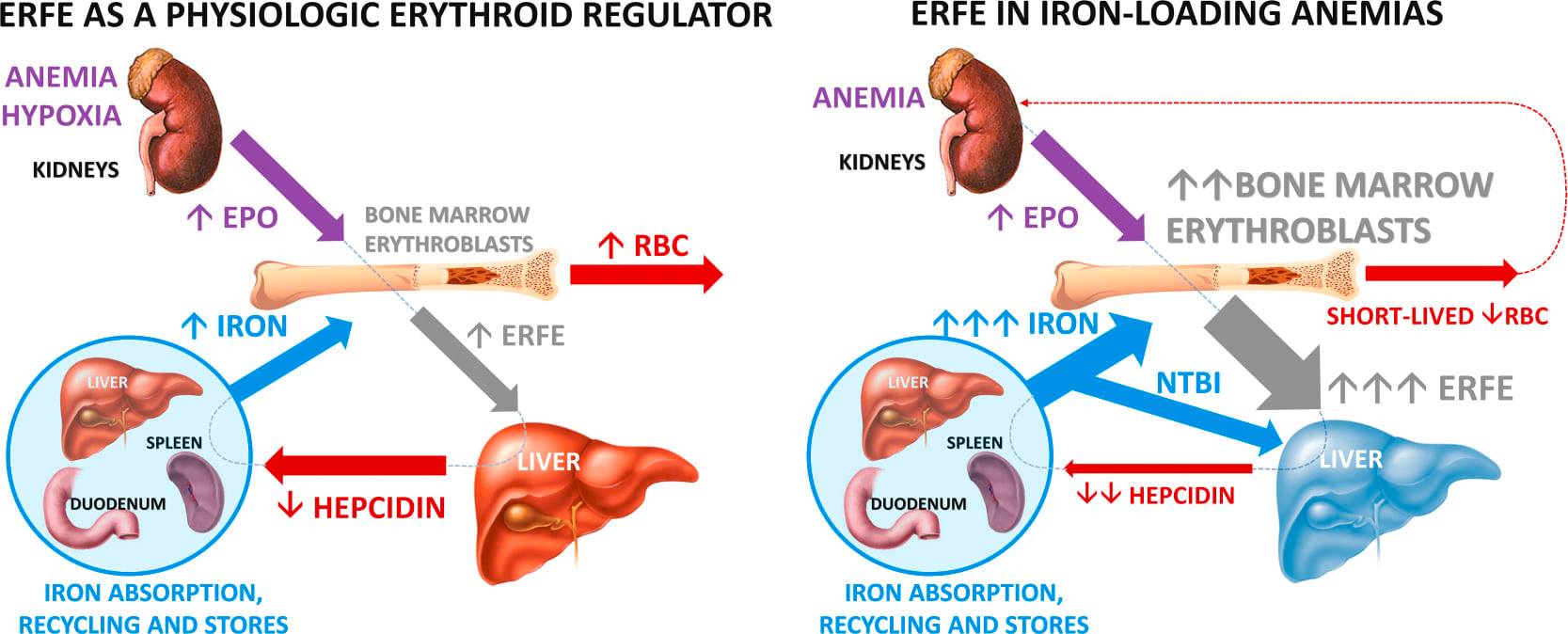
Hepcidin là một hormone peptide nhỏ (25 axit amin) chịu trách nhiệm chính trong việc điều hòa cân bằng nội môi sắt 1 . Đầu tiên được xác định trong nước tiểu, hepcidin chủ yếu được sản xuất bởi tế bào gan 2 và khi được đưa vào lưu thông có thể tương tác với chất xuất khẩu sắt tế bào hoạt động ferroportin, khiến nó bị nội tiết, do đó ngăn chặn sự thoát ra của sắt và khuyến khích giữ sắt của tế bào 3 . Hiện tại hepcidin và ferroportin đại diện cho các cơ quan quản lý duy nhất được biết đến về xuất khẩu sắt tế bào. Ferroportin được thể hiện chủ yếu trong các tế bào liên quan đến sự hấp thu sắt (từ chế độ ăn uống) và cân bằng nội môi; ví dụ bao gồm tế bào ruột non, đại thực bào và tế bào gan.
Biểu hiện Hepcidin được điều chỉnh bởi nồng độ và cửa hàng sắt trong huyết tương; sự kiểm soát phiên mã này được tạo điều kiện bởi thụ thể protein hình thái xương (BMPR) kết hợp với con đường truyền tín hiệu SMAD 4 . Điều quan trọng, nhiễm trùng và viêm cũng điều chỉnh quá trình tổng hợp hepcidin, một phản ứng đáng chú ý nhất liên quan đến hoạt hóa IL-6 của con đường JAK / STAT 5 . Kết quả hạ đường huyết, được mô tả là thiếu máu do viêm, giúp hạn chế độc lực vi sinh vật (xem xét trong 6 ). Hậu quả liên quan đến việc tăng lưu trữ sắt có thể bao gồm thiếu hồng cầu và rối loạn chức năng tế bào liên quan đến tích lũy sắt dư thừa 7, 8 . Về vấn đề này, sắt cũng là một yêu cầu thiết yếu cho sự tăng sinh tế bào; khi có sẵn vượt quá, một trạng thái tăng sinh được khuyến khích 1, 7, 9 . Nhận thức hiện tại cho thấy rằng hầu hết các loại tế bào thể hiện rất ít hoặc không có ferroportin vì sắt chỉ được sử dụng cho các yêu cầu trao đổi chất và do đó không cần phải xuất tài nguyên này. Tuy nhiên, các nghiên cứu mới đang nổi lên chỉ ra biểu hiện và hoặc quy định của ferroportin và hepcidin liên quan đến sự lưu giữ sắt trong các tế bào thuộc các loại ung thư khác nhau 10, 11, 12 với việc giữ sắt có liên quan đến sự sống và tăng sinh của tế bào, do đó cho thấy tầm quan trọng của trục này trong bệnh tăng sinh.
Tăng huyết áp động mạch phổi (PAH) là một quá trình bệnh trong đó cân bằng nội môi sắt bất thường cũng đã được liên quan đến 13 và dư thừa hepcidin đã chứng minh 8 . Nó được đặc trưng bởi sự tăng sản khu vực của các thành phần cơ trơn và tế bào nội mô của sức đề kháng, các tiểu động mạch phổi tiền mao mạch. Được biết đến như một căn bệnh hiếm gặp, PAH được phân loại thành vô căn, di truyền hoặc các dạng dẫn đến kết hợp với các tình trạng cụ thể, chẳng hạn như mô liên kết hoặc bệnh tim bẩm sinh 14 . Đột biến gen, và đặc biệt là những đột biến liên quan đến BMPR II đã nhấn mạnh hầu hết các trường hợp di truyền và một tỷ lệ đáng kể các trường hợp lẻ tẻ của PAH 15 vô căn. Viêm có thể là mối liên hệ phổ biến giữa tín hiệu BMP bị rối loạn và mất sắt; quan trọng là IL-6 huyết tương được nuôi ở bệnh nhân mắc PAH 16 . Một cách hấp dẫn, tăng khả năng tự trị qua trung gian bởi hành động lysosomal (trong đó BMPR-II và ferroportin đều bị thoái hóa) đã được ghi nhận trong PAH 17, cho thấy mối liên hệ với việc xử lý sắt đã thay đổi.
Xem thêm: Bí Thư Đảng Ủy Là Gì – Tổ Chức Của Đảng Cộng Sản Việt Nam
Đối với nguồn sắt cho sự hấp thu của tế bào, điều này rất có thể sẽ được cung cấp thông qua các cơ chế qua trung gian thụ thể transferrin-1. Tuy nhiên, sự công nhận ngày càng tăng rằng hemoglobin tự do có liên quan đến PAH 18, không có kiểu hình bệnh tan máu cổ điển, có thể gợi ý các con đường bổ sung để thu nhận sắt bởi các tế bào mạch máu phổi.
Do đó, nghiên cứu này đã được thực hiện để đánh giá liệu có bất kỳ vai trò nào đối với trục hepcidin / ferroportin trong các phản ứng tăng sinh của các tế bào cơ trơn động mạch phổi. Mục tiêu của nghiên cứu là ba lần. Đầu tiên, để mô tả lần đầu tiên sự hiện diện của protein xuất khẩu sắt, ferroportin trong các tế bào này. Thứ hai, để điều chỉnh biểu hiện / hoạt động của ferroportin trong các tế bào này để đánh giá mọi ảnh hưởng tiếp theo đối với các phản ứng tăng sinh. Thứ ba, để đánh giá bất kỳ vai trò nào đối với hemoglobin tự do trong sự tăng sinh và các cơ chế tiềm năng cho sự hấp thu của tế bào. Những nghiên cứu này có thể cung cấp cái nhìn sâu sắc về vai trò tiềm năng của cân bằng nội môi sắt bị phá vỡ trong việc tu sửa mạch máu, như quan sát trong PAH.
Các kết quả
Ferroportin được thể hiện bằng hPASMC và được điều hòa bởi hepcidin
Ferroportin mRNA và biểu hiện protein được thể hiện trong các tế bào cơ trơn động mạch phổi của con người (hPASMCs) (Hình 1). Biểu hiện mRNA cơ bản ferroportin đã được phát hiện trong các hPASMC kiểm soát. Điều trị hPASMC bằng hepcidin (1 Phag / ml) trong 2, 5 giờ không có ảnh hưởng đáng kể đến mức độ biểu hiện mRNA (Hình 1A). Phân tích Western blot lysates từ các hPASMC kiểm soát cho thấy một dải xấp xỉ 50 kD tương ứng với ferroportin khi so sánh với các lysate ruột người tiêu chuẩn (Hình 1 B). Một ELISA có độ nhạy cao đã được sử dụng để định lượng nồng độ ferroportin. Nồng độ protein ferroportin cơ bản đã giảm rõ rệt 24 giờ sau khi điều trị bằng hepcidin, cho thấy cơ chế kiểm soát điều hòa sau dịch mã (Hình 1C). Hơn nữa, hóa mô miễn dịch theo sau bằng kính hiển vi đồng tiêu đã chứng minh sự định vị bề mặt tế bào cũng như sự phân bố nội bào của ferroportin trong các tế bào chưa được kích thích (Hình 1 D, tấm trên). Điều trị Hepcidin gây ra sự thay đổi trong phân phối ferroportin khỏi bề mặt tế bào, hướng tới nội địa hóa có dấu lấm chấm, gợi ý về sự hình thành mụn nước (Hình 1 D, tấm dưới). Kích thước của các cơ quan có dấu này thay đổi từ 0, 51111M, phù hợp với kích thước của lysosome, cho thấy một vị trí tiềm năng cho sự thoái hóa của ferroportin nội bào. Liên quan đến những phát hiện này, trong các nghiên cứu ban đầu sử dụng các mẫu phổi từ các mô hình chuột của PAH (monocotaline và sugen hypoxia), mức độ nhuộm ferroportin khuếch tán rất thấp đã được nhìn thấy trong các tế bào cơ trơn, ngoài ra còn có một vài tế bào nhuộm mạnh trong mẫu moncrotaline, nhiều khả năng là bạch cầu đơn nhân. Ngoài việc chỉ ra một số sự hiện diện của ferroportin trong các tế bào có liên quan này, không thể giải thích thêm những phát hiện này. Tuy nhiên, về vấn đề này đã có sự giảm rõ rệt về nhuộm ferroportin ở sugen hypoxia lách (kiểm soát dương tính) khi so sánh với lách kiểm soát, gợi ý về phản ứng hepcidin toàn cầu trong mô hình PAH này, xem dữ liệu bổ sung.
Xem thêm: Chung Cư Htv Complex – Chung Cư Phú Thịnh Htv Complex

Ferroportin được thể hiện bằng hPASMC và được điều hòa bởi hepcidin. Các hPASMC kết hợp được ( A ) được xử lý giả hoặc được xử lý bằng 1 gang / mL hepcidin trong 2, 5 giờ và tổng số RNA được chiết xuất bằng bộ RNeasy, cDNA được tổng hợp bằng cách sử dụng mồi oligo-dT và RT-PCR được thực hiện bằng cách sử dụng màu xanh lá cây FBR mồi và-actin là gen giữ nhà. Các giá trị được tiếp tục chuẩn hóa khi các lần thay đổi đối với các ô không được điều khiển tại thời điểm 0. N = 4 ( B ) được xử lý giả trong 24 giờ, các tế bào được ly giải và tổng số protein được chiết xuất, định lượng bằng xét nghiệm của Warren và 40 proteing protein được phân tách trên 10% SDS-PAGE và được chuyển vào màng nitrocellulose. Phương pháp làm mờ phương Tây đã được thực hiện bằng cách sử dụng IgG chống thỏ làm IgG chính và dê chống chuột kết hợp với peroxidase củ cải ngựa làm kháng thể thứ cấp. Lysates đường ruột của con người (Abcam) đã được sử dụng như là kiểm soát tích cực. N = 3 ( C ) hoặc được xử lý giả hoặc được điều trị bằng 1 gang / mL hepcidin trong 24 giờ, các tế bào bị ly giải và tổng số protein được chiết xuất. Biểu hiện Fpn đã được định lượng bằng cách sử dụng bộ ELISA (BlueGene Biotech) và được chuẩn hóa thành tổng protein được ước tính bởi thuốc thử Bradford. N = 4 ( D ) Hình ảnh đồng nhất của hPASMC được trồng bằng (tấm trên cùng) hoặc (tấm dưới cùng) được xử lý bằng 1 gang / mL hepcidin trong 20 Hay22 h và nhuộm miễn dịch với kháng thể kháng Fpn của thỏ và chống thỏ Kháng thể thứ cấp IgG được gắn thẻ Alexa-568. Các tế bào tiếp tục được chống lại với DAPI và hình ảnh được chụp bằng kính hiển vi đồng tiêu Leica LSM 510. Thanh tỷ lệ = 10 đỉnh; N = 5. Bài kiểm tra t của sinh viên đã được thực hiện; ** p 5 và do đó, cân bằng nội môi sắt. Điều trị IL-6 của hPASMC đã chứng minh rõ ràng rằng cả mRNA và bài tiết protein của hepcidin đều tăng đáng kể theo quy định sau 2 giờ và 24 giờ (Hình 2A, B). Được xác định là thay đổi lần so với gen-actin, biểu hiện hepcidin tăng 3, 3 lần với 10 ng / ml IL-6. Ngược lại, 48 giờ sau khi điều trị IL-6, protein ferroportin đã giảm đáng kể 48% so với giá trị đối chứng (p

IL-6 tăng biểu hiện hepcidin và ferroportin được điều chỉnh xuống trong hPASMC. Các hPASMC kết hợp được xử lý giả hoặc xử lý bằng 10 ng / mL IL-6 ( A ) trong 2, 5 giờ và tổng RNA được chiết xuất bằng bộ RNeasy, cDNA được tổng hợp bằng cách sử dụng mồi oligo-dT và RT-PCR được thực hiện bằng cách sử dụng màu xanh lá cây của SYBR Hamp-1) mồi và-actin là gen giữ nhà. Các giá trị được tiếp tục chuẩn hóa khi các lần thay đổi đối với các ô không được điều khiển tại thời điểm 0. N = 4 ( B ) trong 24 giờ, chất siêu lọc truyền thông được thu thập và bài tiết hepcidin được định lượng bằng bộ ELISA (Hệ thống R & D). N = 4 ( C ) trong 24 giờ tế bào bị ly giải và tổng số protein được chiết xuất. Biểu hiện Ferroportin đã được định lượng bằng cách sử dụng bộ ELISA (BlueGene Biotech) và được chuẩn hóa thành tổng protein ước tính bằng thuốc thử của Bradford. N = 4 ( D ) Hình ảnh đồng nhất của hPASMC được trồng bằng (bảng trên cùng) hoặc (bảng dưới) được xử lý với 10 ng / mL IL-6 trong 20 Hay22 h và nhuộm miễn dịch với kháng thể kháng Fpn của thỏ và chống dê Kháng thể thứ cấp IgG được gắn thẻ Alexa-568. Các tế bào tiếp tục được chống lại với DAPI và hình ảnh được chụp bằng kính hiển vi đồng tiêu Leica LSM 510. Thanh tỷ lệ = 10 Pha, N = 5. Bài kiểm tra của sinh viên đã được thực hiện; ** p

Hepcidin và IL-6 kích thích tăng sinh hPASMCs bị ức chế bởi LY2928057. hPASMC được mạ lên 96 tấm giếng (2500 tế bào / giếng). Sau khi tuân thủ ban đầu, các tế bào đã bị bỏ đói trong huyết thanh trong 20 phút 24 giờ trước khi điều trị trước bằng một mình hoặc ( A ) 1 mậtg / mL hepcidin hoặc ( B ) 10 ng / mL IL-6 trong 24 giờ. Sau đó, các tế bào được tiếp xúc với 1 μg / mL LY2928057 hoặc môi trường một mình trong 1, 5 giờ sau đó tiếp tục thử thách lặp lại với hepcidin hoặc IL-6 ở nồng độ chỉ định (hoặc chỉ dùng phương tiện truyền thông) trong 24 giờ. BrdU đã được giới thiệu (ở nồng độ khuyến nghị của nhà sản xuất) trong 24 giờ nữa trước khi thu hoạch các tấm. Sự tăng sinh được định lượng bằng bộ ELISA của BrdU bằng kháng thể chống BrdU-POD. Tất cả các phương pháp điều trị đã được thực hiện trong ba lần. Tất cả các bài đọc đã được chuẩn hóa để kiểm soát các tế bào không được điều trị. Dữ liệu hiển thị là ± SEM. N = 4. ANOVA theo sau là bài kiểm tra hậu hoc Bonferroni đã được thực hiện; * p 20 . Do đó, các thí nghiệm đã được thực hiện để xác định xem liệu điều trị hepcidin và / hoặc IL-6 có lợi cho việc giữ sắt trong hPASMC và thứ hai là nếu ổn định biểu hiện ferroportin với LY2928057 có thể hạn chế sự tích lũy đó. Bằng cách sử dụng xét nghiệm sắt màu, đo tổng lượng sắt (Fe 3+ và Fe 2+ ), không có sự gia tăng đáng kể về sắt trong các tế bào được điều trị bằng hepcidin hoặc IL-6 trong 24 giờ (Hình 4A, bảng bên trái). Tuy nhiên, việc ủ trước với LY2928057 dẫn đến giảm đáng kể nồng độ sắt trong tế bào: 5, 3 lần đối với hepcidin và gấp 4, 16 đối với IL-6 so với 2, 14 đối với các tế bào không được điều trị (Hình 4A, bảng bên phải). Điều thú vị là, thực hiện các phép đo tương tự trong 48 giờ cho thấy hàm lượng sắt trong tế bào tăng đáng kể: gấp 1, 88 lần và 2, 72 lần đối với các tế bào được điều trị bằng hepcidin và IL-6 (Hình 4B, bảng bên trái) mặc dù lượng sắt tế bào có thể đo được giảm quá giới hạn phép đo xét nghiệm trong các tế bào được xử lý trước LY2928057 (Hình 4B, bảng bên phải). Để hỗ trợ thêm, mức độ Protein điều hòa sắt 2 (IREB2), chất thay thế cho mức độ sắt, đã giảm trong các tế bào được điều trị bằng hepcidin hoặc IL-6 và đáng kể đối với các tế bào được điều trị bằng hepcidin (Hình 4).
Chuyên mục: Hỏi Đáp