Giới thiệu

Liên kết websiteĐại học Duy TânCổng thông tin sinh viênDiễn đàn Duy TânĐoàn thanh niên – Đại học Duy Tân

KHOA KHOA HỌC TỰ NHIÊN
Phụ trách các học phần thuộc Khối kiến thức giáo dục đại cương trong các chương trình đào tạo tại Trường Đại học Duy Tân.
Bạn đang xem: Dung dịch đệm là gì
KHOA KHOA HỌC TỰ NHIÊN
Đảm nhận các học phần Toán học, Vật lý, Hóa học và Sinh học ở các chương trình đào tạo của Trường.
KHOA KHOA HỌC TỰ NHIÊN
Xây dựng chương trình, kế hoạch giảng dạy và chủ trì tổ chức quá trình đào tạo các học phần Toán học, Vật lý, Hóa học và Sinh học đại cương.
1. Định nghĩa
Dung dịch đệm là dung dịch có pH thay đổi không đáng kể khi thêm vào đó một ít axit, bazơ hay pha loãng chúng.
2. Thành phần của dung dịch đệm và cơ chế tác dụng đệm
Một hệ đệm có thể gồm các chất sau:
CH3COOH + CH3COONa
NaHCO3 + Na2CO3
NH4Cl + NH3
Axit + Bazơ
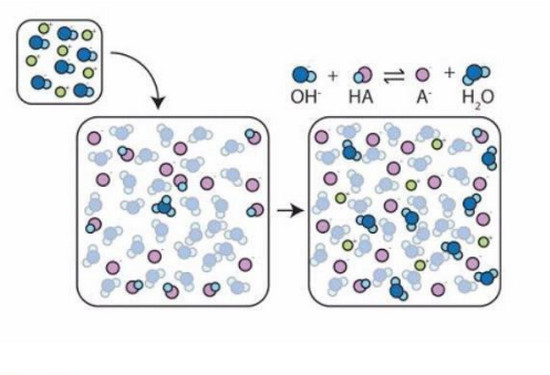
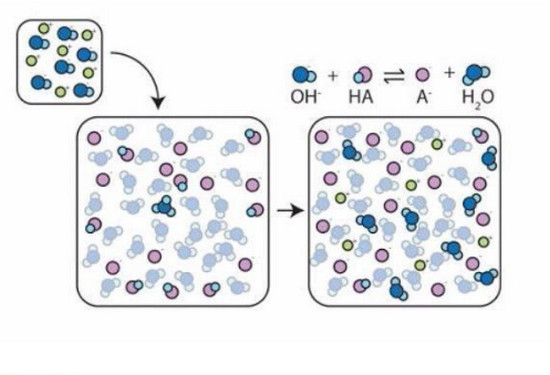
Một cách tổng quát trong hệ đệm có mặt đồng thời với một tương quan đáng kể của hai dạng axit và bazơ của một cặp axit và bazơ liên hợp. Nghĩa là trong dung dịch đệm luôn luôn tồn tại cân bằng:
HA ⇔ H+ + A-
Vì vậy, khi thêm vào dung dịch đệm H+, cân bằng trên sẽ dịch chuyển theo chiều nghịch tạo ra axit điện li yếu HA. Ngược lại khi thêm bazơ OH-hay pha loãng, nồng độ H+bị giảm xuống thì đồng thời cân bằng sẽ dịch chuyển theo chiều thuận để tạo thêm H+và do đó pH không bị thay đổi.
Xem thêm: Dabbing là gì
3. pH của dung dịch đệm
Giả sử dung dịch đệm gồm axit HA với nồng độ , hằng số Kavà bazơ liên hợp A-với nồng độ . Từ cân bằng điện li:
HA ⇔ H+ + A-
Một cách tổng quát pH của dung dịch đệm:
pH = pKa + log (/)
Phương trình trên gọi là phương trình Henderson – Hasellbalch.
Lưu ý: tỷ số nồng độ(/)cũng là tỷ số mol của bazơ liên hợp và axit liên hợp trong dung dịch đệm.
Dựa vào phương trình Henderson – Hasellbalch, ta có thể:
– Tính pH của dung dịch đệm nếu biết pKa, , .
Ví dụ: Tính pH của dung dịch đệm gồm: 100ml dung dịch CH3COOH 0,1M và 50ml dung dịch CH3COONa 0,4M.
Xem thêm: Webservice Là Gì – Web Service Là Gì
pH = 4,76 + log = 5,06
Kinh nghiệm cho thấy, để đảm bảo một dung dịch đệm có khả năng đậm tốt thì nồng độ của một dạng này (axit hay bazơ liên hợp) không nên gấp quá 10 lần nồng độ của dạng kia. Điều đó có nghĩa là một dung dịch đệm tốt trong khoảng pH = pKacộng trừ 1.
Chuyên mục: Hỏi Đáp