Trung tâm luyện thi, gia sư – dạy kèm tại nhà NTIC Đà Nẵng giới thiệu phần KHÁI NIỆM, PHÂN LOẠI CHẤT ĐIỆN LI, SỰ ĐIỆN LI. nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này.
Bạn đang xem: độ điện li là gì
I. THÍ NGHIỆM VÀ ĐỊNH NGHĨA
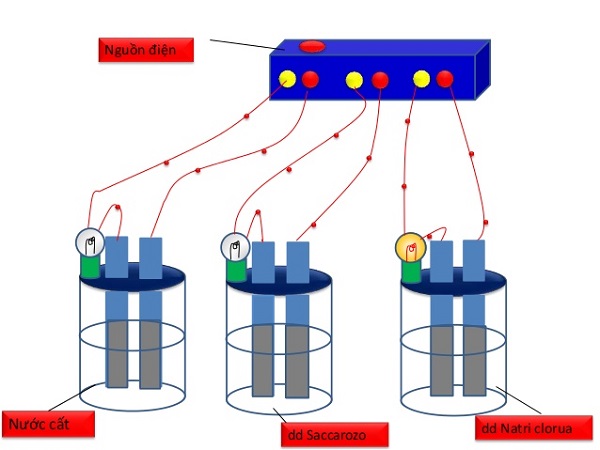
1. Thí nghiệm
2. Định nghĩa
– Chất điện li: là những chất khi tan trong nước tạo thành dung dịch có tính dẫn điện.
– Sự điện li: là quá trình phân li các chất trong nước ra ion. Những chất khi tan trong nước phân li ra ion được gọi là chất điện li.
– Chất điện li gồm có: axit, bazo và muối.
3. Cơ chế của quá trình điện li
a. Cơ chế của quá trình điện li
b. Biểu diễn sự điện li
– Quá trình điện li của các chất điện li được biểu diễn bằng các phương trình điện li:
NaCl→Na++ Cl-
HCl→H++ Cl-
CH3COOH

H++ CH3COO-
4. Độ điện li
–Độ điện li α (anpha) của chất điện li là tỉ số giữa số phân tử phân li ra ion (n) và tổng số phân tử hòa tan (no)
α =
– Độ điện li của các chất điện li khác nhau nằm trong khoảng 0
– Độ điện li được thường được biểu diễn dưới dạng phần trăm.
– Độ điện li phụ thuộc vào nhiệt độ, nồng độ dung dịch, bản chất của chất tan và dung môi.
Xem thêm: Tải Game Liên Quân Trên Máy Tính, Garena Liên Quân Mobile
II. PHÂN LOẠI CHẤT ĐIỆN LI
Có 2 loại chất điện li Chất điện li mạnh và chất điện li yếu
1. Chất điện li mạnh
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
– Chất điện li mạnh có α = 1
– Chất điện li mạnh bao gồm: các axit mạnh HCl, HNO3, H2SO4…., các bazo mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)2… và hầu hết các muối.
– Phương trình điện li của chất điện li mạnh: dùng dấu mũi tên 1 chiều chỉ chiều của quá trình điện li
H2SO4→2H++ SO42-
2. Chất điện li yếu
– Chất điện li yếu: là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
– Độ điện li của các chất điện li yếu nằm trong khoảng 0
– Chất điện li yếu gồm: các axit yếu, các bazo yếu…
– Phương trình điện li của các chất điện li yếu: dùng dấu mũi tên 2 chiều
Mg(OH)2

Mg2++ 2OH-
* Lưu ý: Sự điện li của chất điện li yếu là quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân li ra ion và tốc độ kết hợp các ion thành phân tử là bằng nhau. Cân bằng điện li là cân bằng động, cũng có hằng số cân bằng K và tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê, giống như mọi cân bằng hóa học khác.
Xem thêm: Sound Là Gì
– Ảnh hưởng của sự pha loãng đến sự điện li:Khi pha loãng dung dịch, độ điện li của các chất điện li đều tăng. Do sự pha loãng khiến cho các ion (+) và (-) của chất điện li rời xa nhau hơn, ít có điều kiện va chạm vào nhau để tạo lại phân tử, đồng thời sự pha loãng không làm cản trở đến sự điện li của các phân tử.
Trung tâm luyện thi, gia sư – dạy kèm tại nhà NTIC Đà Nẵng
LIÊN HỆ NGAY VỚI CHÚNG TÔI ĐỂ BIẾT THÊM THÔNG TIN CHI TIẾT
ĐÀO TẠO NTIC
Chuyên mục: Hỏi Đáp