1. Giới thiệu các loại phức Chelate, hợp chất hóa học tạo phức Chelate
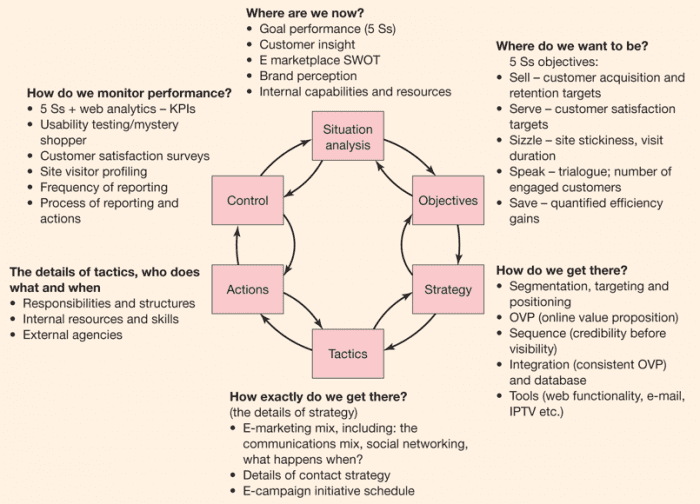
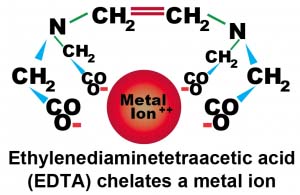
Chelate là phức chất vòng càng giữa các hợp chất hữu cơ dẫn xuất từ amino polycacboxylic axit với các ion kim loại.
Bạn đang xem: Chelate là gì
1.1. Các dạng phức Chelate
Các dạng tồn tại của trung, vi lượng chelate thường ở hai dạng chủ yếu sau:
– EDTA viết tắt từ chữ: Ethylen Diamin Tetraacetic Axit và
– EDDHA, viết tắt từ chữ: Ethylene Diamin Di(o-Hydroxyphenylacetic) Axit, ngoài hai dạng trên đôi khi còn ở dạng:
– EHPG viết tắt từ chữ: (N,N’-Ethylenebis-2-(o-HydroxyPhenyl) Glycine) một dạng chiết xuất từ Amino axit.
1.2. Các hợp chất hữu cơ dẫn xuất từ amino Polycacboxylic axit
NTA – Nitrilo Triaxetic Axit

EDTA – Etylen Diamino Tetraaxetic Axit.
– Etylen Diamino Tetraxetic Axit (EDTA): H4Y
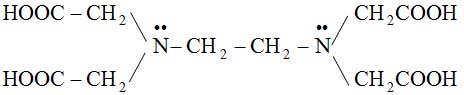
(H4Y tan kém trong nước, nên khi chuẩn bị dung dịch khó khăn)
– Dinatri etylen diamino tetra axit: Na2H2Y
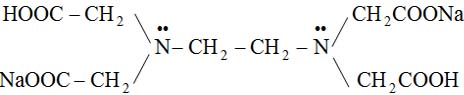
(Na2H2Y dễ tan hơn trong nước hơn H4Y)
Để phản ứng xảy ra được dễ dàng người ta thường dùng Na2H2Y làm dung dịch tạo phức. Vì vậy để thuận tiện cho việc gọi tên ta quy ước H4Y và NaH2Y đều gọi chung là EDTA.
Ethylene Diamine-N,N’-bis (2-Hydroxyphenylacetic) Axit: EDDHA
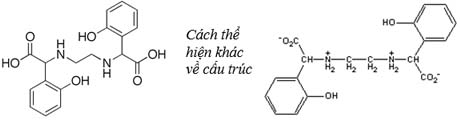
EDDHA được biết với tên thông thường là Ethylene Diamine Di (o-hydroxy phenyl acetic) Axit, hoặc EHPG . Nó có những liên kết mạnh giữa những nhóm phenolic và các kim loại (đặc biệt là Fe(III), Zn, Mn). Những liên kết này mạnh hơn nhiều những liên kết thuần tuý của Cacboxylic chelates của EDTA.
DTPA – Diethylene Triamine Pentaacetic Acid
Là hoá chất đắt tiền, được sử dụng nhiều trong lĩnh vực dược để sản xuất các thuốc uống có chứa vi lượng: Zinc-DTPA, Canxi-DTPA…
Trong khuôn khổ bài viết này chúng ta chỉ nghiên cứu về phức EDTA Chelate, phức điển hình được làm nguyên liệu trong sản xuất phân bón và pha chế dung dịch dinh dưỡng cây trồng thủy canh.
1.3. Tìm hiểu về EDTA, EDTA là gì?, tính chất vật lý hóa học của EDTA
– EDTA là từ viết tắt củaEthyleneDiamineTetraaceticAcid. Đây là một axít hữu cơ mạnh (hơn 1.000 lần so với axít acetic), được tổng hợp vào năm 1935 bởi nhà bác học F. Munz.
– EDTA và các muối của nó thường ở dạng tinh thể màu trắng hoặc bột, không bay hơi và có độ tan cao trong nước.

– EDTA được tổng hợp từ ethylenediamine (C2H4(NH2)2),formol (HCHO) và gốc cyanide (HCN hoặc NaCN).
Xem thêm: Biến áp Cách Ly Là Gì, Máy So Sánh Cấu Tạo Và Phân Loại
– Các sản phẩm thương mại thường ở dạng muối như là CaNa2EDTA, Na2EDTA, Na4EDTA, NaFeEDTA,…
– EDTA phân hủy (cháy khét) ở nhiệt độ > 160oC.
2. Cơ sở lý thuyết tạo phức trung, vi lượng dạng EDTA Chelate
2.1. Sự tạo phức của EDTA và ion kim loại
– EDTA trong nước là axit yếu, phân ly theo 4 nấc có các hằng số pK1= 2,0; pK2= 2,67; pK3= 6,16; pK4= 10,26.
– Trong dung dịch EDTA phân ly theo phương trình: Na2H2Y → 2Na++ H2Y2-
Anion H2Y2-tạo phức với hầu hết các cation kim loại:
M++ H2Y2-= MY3-+ 2H+(kim loại hóa trị I)
M2++ H2Y2-= MY2-+ 2H+(kim loại hóa trị II)
M3++ H2Y2-= MY-+ 2H+(kim loại hóa trị III)
M4++ H2Y2-= MY+ 2H+(kim loại hóa trị IV)
Phản ứng tổng quát của EDTA với ion kim loại: Mn++ H2Y2-= MY(n-4)+ 2H+
Ta nhận thấy:
– Các ion kim loại không phân biệt hoá trị tạo phức với EDTA theo mol là 1:1
2.2. Mô tả giải thích quá trình phản ứng của Cation kim loại với EDTA
– Sự tạo thành phức của kim loại với Amoniac (NH3): phân tử NH3kết hợp với các ion kim loại bằng những liên kết cho nhận giữa cặp electron tự do của N với ion kim loại tạo thành những chất tan trong dung dịch.
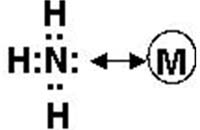
– Đối với Ethylenediamin hai phân tử amoniac sẽ cùng liên kết với ion kim loại. Mỗi một nitơ sẽ cho nhận 1 cặp điện tử, như vậy sẽ hình thành một liên kết đồng hoá trị với ion kim loại.
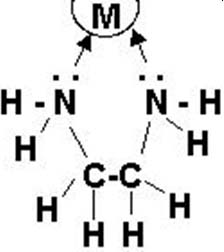
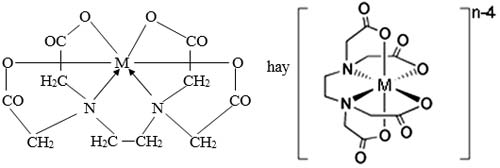
– Đối với EDTA các hidro được thay thế bởi Ion Axetat. Một trong những oxi trong Axetat lại có khả năng hình thành mối liên kết khác với ion kim loại (Trong ion Axetat có hai nguyên tử oxi với bốn cặp điện tử, nhưng chỉ có một ion duy nhất có thể hướng về phía ion kim loại, và ion axetat sẽ mất đi một hidro để hình thành liên kết C-N).
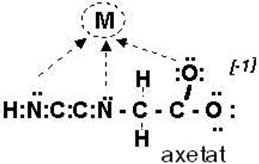
Cấu trúc phức chelate
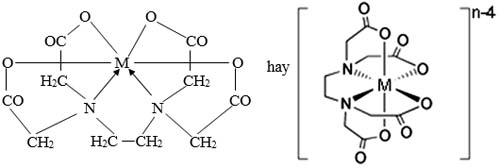
Độ bền của các phức chelate kim loại phụ thuộc vào pH dung dịch và cấu trúc electron của ion trung tâm.
2.3. Ảnh hưởng của pH môi trường đối với phản ứng giữa ion kim loại với EDTA
Trong phản ứng tạo phức luôn đẩy ra 2 ion H+, do vậy độ bền của phức chịu sự ảnh hưởng của pH môi trường là khá lớn.
– Hằng số bền của phức (Kb):
Trong dung dịch phức MY phân ly theo phương trình: MY(n-4)→ Mn++ Y4-
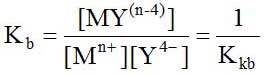
Trong đó phụ thuộc vào pH môi trường (nồng độ H+) vì:
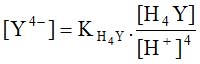
– Vì vậy khả năng tạo phức với kim loại (hằng số bền của phức Kb) phụ thuộc vào pH của dung dịch, chẳng hạn như Ca2+và Mg2+yêu cầu pH khoảng 10. Mặt khác, sự tạo phức với các kim loại còn phụ thuộc vào hằng số hình thành phức, hằng số càng cao thì khả năng tạo phức càng cao.
Xem thêm: Format Là Gì – Format Trong Tiếng Tiếng Việt
– EDTA di chuyển vào trong đất và tạo phức với các kim loại vết cũng như là các kim loại kiềm thổ (Na+, K+, Ca2+,…), từ đó làm tăng độ hòa tan của kim loại. Đặc biệt là trong đất phèn, EDTA sẽ tạo phức kẹp (chelate) Fe-EDTA từ đó làm giảm quá trình hoạt động của Fe3+. Trong môi trường kiềm, EDTA lại tạo phức chủ yếu với Ca2+và Mg2+tạo thành CaMg-EDTA làm giảm độ cứng của nước.
2.4. Một số phức EDTA chelate, tính chất hóa lý và độ bền của phức
Một số phức EDTA chelate ứng dụng làmdinh dưỡng cây trồngsau:
Chuyên mục: Hỏi Đáp