Bạn đang ở: Home Chương 5. Hidrocacbon no Lý thuyết về ankan
Chương 5. Hidrocacbon no
Lý thuyết về ankan
Chi tiếtChuyên mục: Chương 5. Hidrocacbon noĐược viết ngày Thứ sáu, 26 Tháng 12 2014 11:46Viết bởi Nguyễn Văn Đàm
I. KHÁI NIỆM, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP
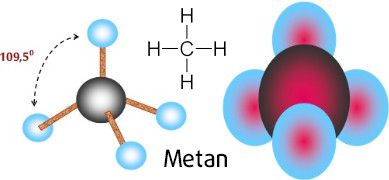
– Định nghĩa: ankan (parafin) là những hiđrocacbon no, mạch hở.
Bạn đang xem: Ankan là gì
– Công thức chung: CnH2n+2 (n ≥ 1).
– Tên gọi:
+ Tên thay thế:
Số chỉ vị trí nhánh + tên nhánh + tên mạch chính + an
+ Tên thường:
Nếu chỉ có một nhánh duy nhất CH3 ở nguyên tử C số 2 thì thêm tiền tố iso, nếu có 2 nhánh CH3 ở C số 2 thì thêm tiền tố neo. Chú ý phân biệt isoankan với isoankyl và neoankan với neoankyl. Isooctan là 2,2,4 – trimetylpentan.
– Đồng phân: mạch C.

Một số ankan đơn giản thường gặp
II. TÍNH CHẤT VẬT LÍ
– Ở nhiệt độ thường, các ankan từ C1 đến C4 ở trạng thái khí; từ C5 đến khoảng C18 ở trạng thái lỏng; từ khoảng C18 trở lên ở trạng thái rắn.
– Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của ankan nói chung đều tăng theo số nguyên tử C trong phân tử tức là tăng theo phân tử khối. Ankan nhẹ hơn nước.
– Ankan không tan trong nước và đều là những chất không màu.
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế (Cl2/as hoặc Br2/t0)
CnH2n+2 + xX2 → CnH2n+2-xXx + xHX
– Về nguyên tắc các nguyên tử H trong phân tử ankan có thể bị thay thế lần lượt từ 1 đến hết.
– Khả năng phản ứng: Cl2 > Br2 > I2 và Cbậc 3> Cbậc 2 > Cbậc 1. Sản phẩm chính là sản phẩm ưu tiên thế X vào H của C bậc cao (C có ít H hơn). C bậc a là C liên kết với a nguyên tử C khác.
– Phản ứng thế xảy ra theo cơ chế gốc tự do – dây chuyền gồm 3 giai đoạn:
+ Khơi mào phản ứng:
X2 → 2X.
+ Phát triển mạch:
X. + CnH2n+2 → CnH2n+1. + HX
CnH2n+1. + X2 → CnH2n+1X + X.
Xem thêm: Tải Game Liên Minh – Download Liên Minh Huyền Thoại 11
+ Tắt mạch:
2X. → X2
X. + CnH2n+1. → CnH2n+1X
CnH2n+1. + CnH2n+1. → C2nH4n+2
Lưu ý: Số sản phẩm thế 1 lần (monohalogen) cũng chính là số gốc ankyl mà các đồng phân tạo ra = số loại nguyên tử H tương đương = số loại nguyên tử C tương đương (trừ C bậc 4).
2. Các phản ứng xảy ra do tác dụng của nhiệt
a. Phản ứng tách H2 (phản ứng đề hiđro hóa)
CnH2n+2 → CnH2n + H2 (Fe, t0)
Anken
Chú ý:
– Chỉ những ankan trong phân tử có từ 2 nguyên tử C trở lên mới có khả năng tham gia phản ứng tách H2.
– Trong phản ứng tách H2, 2 nguyên tử H gắn với 2 nguyên tử C nằm cạnh nhau tách ra cùng nhau và ưu tiên tách H ở C bậc cao.
CH3-CH2-CH3 → CH2=CH-CH3 + H2
– Một số trường hợp riêng khác:
CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2
CH3-CH(CH3)-CH2-CH3 → CH2=C(CH3)-CH=CH2 + 2H2
n-C6H14 → 4H2 + C6H6 (benzen)
n-C7H16 → 4H2 + C6H5CH3 (toluen)
b. Phản ứng phân hủy
– Phản ứng phân hủy bởi nhiệt:
CnH2n+2 → nC + (n + 1)H2 (t0)
– Phản ứng phân hủy bởi halogen (Cl2 hoặc F2):
CnH2n+2 + nCl2 → CnCl2n+2 + (n + 1)H2 (t0)
c. Phản ứng crăcking (n≥ 3)
CnH2n+2 → CxH2x+2 + CyH2y (t0, p, xt)
Chú ý:
+ Ankan thẳng CnH2n+2 khi crăcking có thể xảy ra theo (n – 2) hướng khác nhau tạo ra 2(n-2) sản phẩm.
+ Nếu hiệu suất phản ứng crăcking là 100% và không có quá trình cracking thứ cấp thì tổng số mol sản phẩm tăng gấp đôi so với các chất tham gia nên KLPTTB giảm đi một nửa.
+ Số mol ankan sau phản ứng luôn bằng số mol ankan ban đầu dù quá trình cracking có nhiều giai đoạn.
3. Phản ứng cháy
CnH2n+2 + (3n + 1)/2O2 → nCO2 + (n + 1)H2O
– Đối với phản ứng cháy của ankan cần lưu ý 2 đặc điểm:
+ nCO2 H2O.
+ nH2O – nCO2 = nankan bị đốt cháy.
– Nếu đốt cháy 1 hiđrocacbon mà thu được nCO2 H2O thì hiđrocacbon đem đốt cháy thuộc loại ankan.
– Nếu đốt cháy hỗn hợp hiđrocacbon cho nCO2 H2O thì trong hỗn hợp đốt cháy có chứa ít nhất 1 ankan.
Xem thêm: Avatar 261 Android Mod Auto,anh
Chú ý: Nếu cho ankan tham gia phản ứng với oxi khi có mặt muối Mn2+ thì xảy ra phản ứng oxi hóa không hoàn toàn tạo RCOOH.
Chuyên mục: Hỏi Đáp