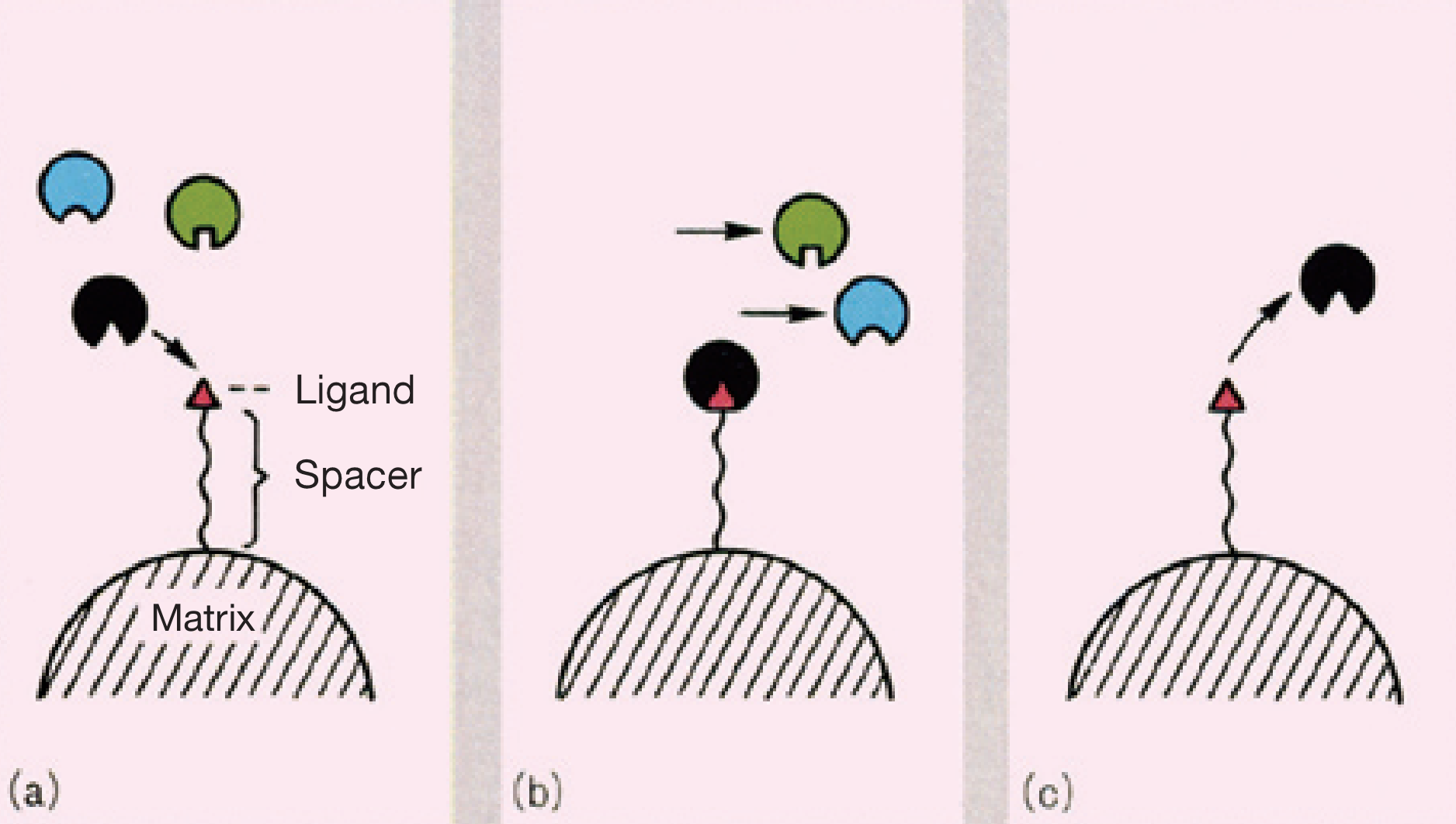
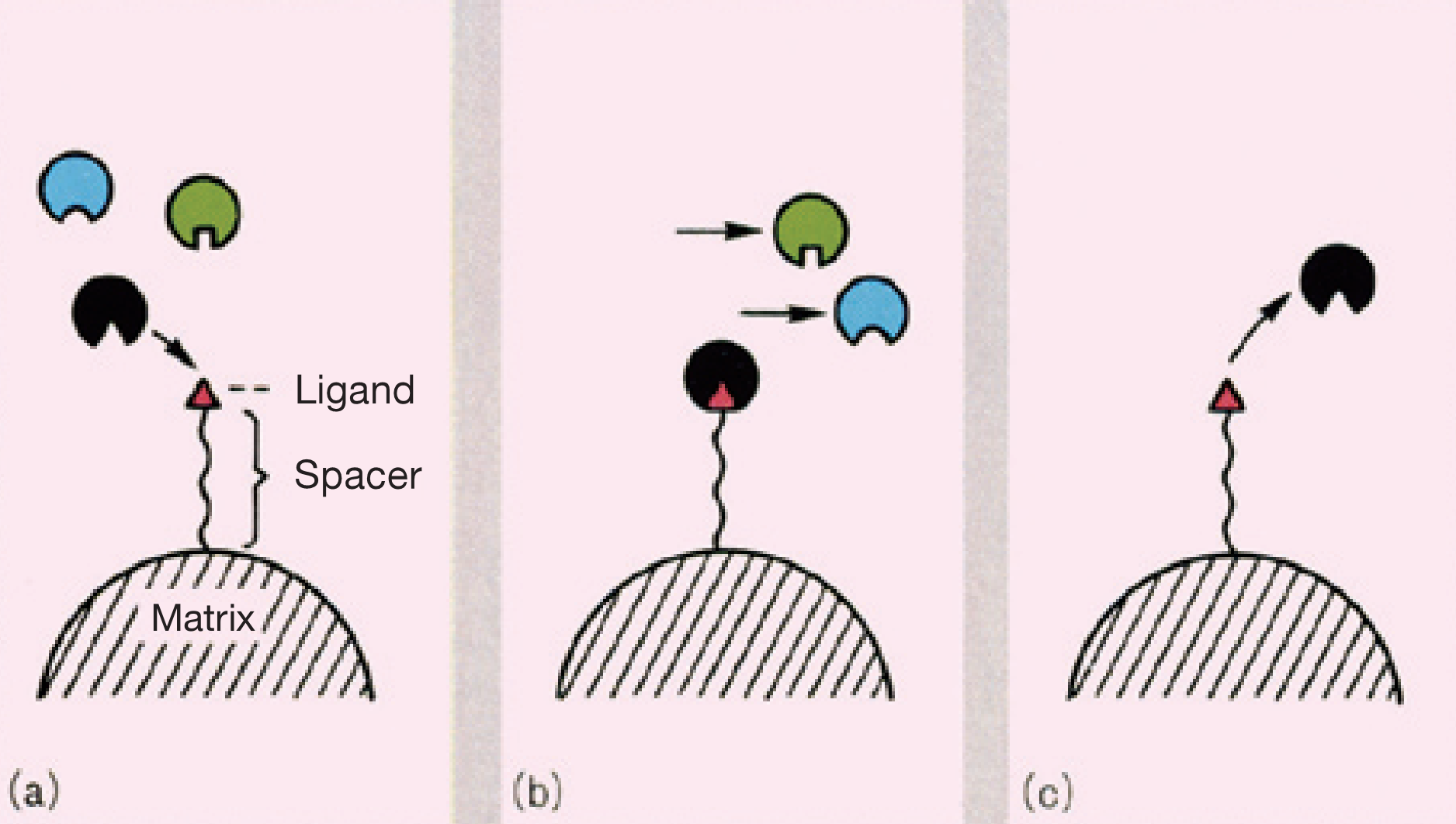
Phối tử là một nguyên tử , ion hoặc phân tử tặng hoặc chia sẻ một hoặc nhiều electron của nó thông qua liên kết cộng hóa trị với nguyên tử hoặc ion trung tâm. Nó là một nhóm tạo phức trong hóa học phối trí để ổn định nguyên tử trung tâm và xác định khả năng phản ứng của nó. Phối tử thường được coi là bazơ Lewis , mặc dù một vài trường hợp tồn tại phối tử axit Lewis.
Bạn đang xem: Ligand là gì
Một số nguồn chỉ coi phối tử là các nhóm chức liên kết với một phức kim loại trung tâm. Trong những trường hợp này, các liên kết được hình thành bên trong phối tử có thể từ cộng hóa trị đến ion trong tự nhiên.
Ví dụ về phối tử
Phối tử đơn tâm có một nguyên tử có thể liên kết với nguyên tử hoặc ion trung tâm. Nước (H 2 O) và amoniac (NH 3 ) là những ví dụ về phối tử monodentat trung tính.
Xem thêm: Wan Là Gì – Mạng Diện Rộng
Một phối tử đa tuyến có nhiều hơn một vị trí của nhà tài trợ. Bidentate ligands có hai địa điểm tài trợ. Các phối tử đinh ba có ba vị trí liên kết. 1,4,7- triazaheptane (diethylenetriamine) là một ví dụ về một ligand tridentate . Các phối tử tetradentat có bốn nguyên tử liên kết. Phức chất có phối tử đa nhân được gọi là chelate .
Xem thêm: Seals Là Gì – Seal Quan Trọng Với Xuất Nhập Khẩu Ra Sao
Một ligand ambidentate là một ligand monodentate có thể ràng buộc ở hai nơi có thể. Ví dụ, ion thiocyanat, SCN – , có thể liên kết với kim loại trung tâm ở lưu huỳnh hoặc nitơ.
Nguồn
Bông, Frank Albert; Geoffrey Wilkinson; Carlos A. Murillo (1999). Hóa học Vô cơ nâng cao . Wiley-Interscience. ISBN 978-0471199571.Jackson, W. Gregory; Josephine A. McKeon; Silvia Cortez (2004). “Các đối tác vô cơ của Alfred Werner của Axit Tartaric Racemic và Mesomeric: Một cột mốc được xem xét lại.” Hóa học vô cơ . 43 (20): 6249–6254. doi: 10.1021 / ic040042e



Deutsch Español 한국어 Svenska 日本語 magyar čeština Bahasa Indonesia Русский язык Nederlands Bahasa Melayu Italiano Français ελληνικά Türkçe Українська العربية dansk tiếng việt български slovenčina Suomi српски român polski português हिन्दी ภาษาไทย
Chuyên mục: Hỏi Đáp